Вы являетесь медицинским работником? Для полного доступа к медицинской информации войдите или зарегистрируйтесь.
Диффузная В-клеточная крупноклеточная лимфома (ДВККЛ): через гетерогенность к верному диагнозу
ДВККЛ NOS (БДУ) — наиболее частый вариант В-клеточных крупноклеточных лимфом
По материалам Л.Г.Бабичевой, И.В. Поддубной
«Гетерогенная диффузная В-клеточная крупноклеточная лимфома: правильный диагноз как залог успешной терапии»
https://doi.org/10.26442/18151434.2023.2.202237
Диффузная В-клеточная крупноклеточная лимфома (ДВККЛ, large B-cell lymphoma) представляет примерно 1/3 всех неходжкинских лимфом в западных странах и 40% во всем мире. Приблизительно в 80% всех случаев ДВККЛ не имеет признаков, позволяющих включить ее ни в одну из диагностических категорий, поэтому ее обозначают как неспецифицированный вариант ДВККЛ NOS (или ДВККЛ без дополнительных уточнений, ДВККЛ БДУ)1. Этот вариант включает в себя подтипы GCB (герминального / зародышевого центра) и non-GCB (ABC, активированные В-лимфоциты, и U, неклассифицируемый). DEL (лимфома с коэкспрессией MYC/ BCL2) также относится к ДВККЛ NOS2.
Медиана возраста при постановке диагноза ДВККЛ составляет 66 лет, однако заболевание может развиться в любом возрасте. Несколько чаще наблюдается у мужчин: 6,7 случая на 100 тыс. населения против 4,6 случая у женщин. Вероятность развития ДВККЛ увеличивается с возрастом: с 0,13 и 0,09% до 39 лет, до 1,77 и 1,4% после 70 лет у мужчин и женщин, соответственно. Пятилетняя общая выживаемость (ОВ) снижается с возрастом с 78% для лиц моложе 55 лет до 54% для лиц старше 65 лет2.
Диагностика ДВККЛ
ДВККЛ характеризуется агрессивным течением, быстрым ростом и В-симптомами, которые включают лихорадку, ночную потливость и потерю веса. Для выбора адекватного лечения решающее значение имеет правильная диагностика.
Диагноз ДВККЛ ставят на основании эксцизионной биопсии увеличенного лимфатического узла, выявленного при клиническом обследовании и при помощи визуальных методов диагностики. Это позволяет исследовать наибольшее количество ткани и минимизировать риск ошибок, возможных при тонкоигольной аспирации или Core-биопсии.
Экстранодальные зоны в дебюте заболевания присутствуют примерно у 1/3 пациентов. Наиболее часто вовлечены органы желудочно-кишечного тракта, за которыми следуют кости, яички, слюнные железы, щитовидная железа, печень, почки, надпочечники, и головной мозг. Выявляются они позитронно-эмиссионной томографией, совмещенной с компьютерной томографией (ПЭТ/КТ), и используются для определения предпочтительного участка для биопсии3.
Морфология ДВККЛ
Клетки ДВККЛ расположены диффузно, что полностью или частично стирает нормальную архитектонику лимфоузла или экстранодального органа. Группы клеток могут быть разделены фиброзом или склерозом. Возможны присутствие малых Т-лимфоцитов и гистиоцитов, участки некроза, апоптоз отдельных клеток, и высокая скорость митоза. Около 10% случаев ДВККЛ представлены рисунком звездного неба, что связано с высокой скоростью прогрессирования.
По Кильской классификации различают три основных морфологических варианта ДВККЛ4. Центробластный вариант, составляющий примерно 80% всех случаев, чаще наблюдается при подтипе GCB и может указывать на возможность трансформации опухоли из фолликулярной лимфомы. Представлен средними клетками с узким ободком цитоплазмы, большим везикулярным ядром, везикулярным хроматином и 2–4 маленькими ядрышками, расположенными вблизи ядерной мембраны. Этот вариант также может демонстрировать спектр от мономорфных опухолей из центробластов (больше 90%) до полиморфных опухолей из смеси центробластов, центроцитов и иммунобластов.
Иммунобластный вариант ассоциируется с подтипом АВС и в 33% случаев определяется по транслокации гена MYC, признаком более агрессивного течения заболевания. Представлен пластами крупных клеток с умеренной или широкой цитоплазмой, мономорфным ядром с одиночным крупным ядрышком. Такая морфология служит важным фактором неблагоприятного прогноза у пациентов, получавших лечение по схеме R-CHOP.
Анапластический вариант встречается гораздо реже и составляет около 3% всех случаев ДВККЛ. Характеризуется инфильтрацией очень крупными клетками с многодольчатыми ядрами. Клетки могут имитировать клетки Ходжкина и Рид–Штернберга или клетки анапластической крупноклеточной лимфомы.
Иммунофенотип ДВККЛ
ДВККЛ характеризуется высокой митотической и пролиферативной активностью. Индекс пролиферации Ki-67 чаще колеблется в диапазоне от 40 до 90%, но может быть и выше5.
Иммунофенотип опухоли характеризуется экспрессией пан-В-клеточных антигенов CD20, CD19, CD79a, PAX-5 (мономорфная интенсивная ядерная экспрессия), CD45 и отсутствием экспрессии CD3. CD30 (мембранная +/- реакция dot-like) может быть частично экспрессирован. CD5+ при ДВККЛ встречается примерно в 10% наблюдений. В этих случаях для исключения полиморфноклеточного / бластоидного варианта лимфомы необходима ИГХ (иммуногистохимия) с антителами к циклину D1. С помощью ИГХ-алгоритма и суррогатных маркеров CD10, ВCL6, MUM1 или CD10, BCL6, FOXP1 могут быть выделены ИГХ-подгруппы ДВККЛ: GCB и non-GCB4.
Для выявления случаев ДВККЛ с неблагоприятным прогнозом рекомендуется исследовать наличие/ отсутствие коэкспрессии MYC/BCL2 (DEL — double expressor лимфома). Данный вариант, наблюдающийся в 30% случаев, чаще при ABC, ассоциирован с более неблагоприятным прогнозом, чем гиперэкспрессия любого из этих маркеров в отдельности6.
Методом FISH может определяться двойная (DH) или тройная (TH) перестройка генов MYC, BCL2 и/или BCL6, как индикаторов агрессивной ДВККЛ высокой степени злокачественности (HGBL). Перестройка MYC наблюдается в 12% случаев, тогда как одновременная перестройка MYC с реаранжировкой BCL2, и/или BCL6 встречается в 4–8% случаев. Такие пациенты плохо отвечают на R-CHOP терапию и нуждаются в более интенсивной терапии, такой как режим R-DA-EPOCH с поправкой на дозу (этопозид, преднизолон, винкристин, циклофосфамид и доксорубицин с ритуксимабом). Но учитывая стоимость метода, клиницисту необходимо знать, что FISH-анализ обязателен в следующих случаях:
- ДВККЛ с бластоидной морфологией (за исключением случаев лимфобластной лимфомы или циклин D1+ плеоморфной/ бластоидной мантийноклеточной лимфомы).
- ДВККЛ с морфологией между ДВККЛ и лимфомой Беркитта. В этих случаях необходима дифференцировать между HGBL DH/TH, HGBL NOS и лимфомой Беркитта.
Молекулярная субклассификация ДВККЛ — подход будущего
Молекулярная субклассификация ДВККЛ, предложенная Chapuy7, основана на комплексном генетическом анализе, различает 5 кластеров внутри одного и того же молекулярного подтипа ДВККЛ (GCB и ABC по COO), радикально отличающихся по клиническим проявлениям, течению и прогнозу.
Ежегодно представления о молекулярной неоднородности ДВККЛ расширяются и пополняются новыми открытиями. Со временем кластеризация ДВККЛ будет иметь большее клиническое значение, поскольку сможет оказывать влияние на тактические терапевтические решения. В настоящий момент в практике клиницистов есть возможности для определения морфологических вариантов ДВККЛ, COO, экспрессии генов и генетических реаранжировок, что является важным фундаментом для построения лечебного алгоритма.
Стадирование ДВККЛ
В последние годы все большее значение в диагностике ДВККЛ придается ПЭТ/КТ с 18F-фтордезоксиглюкозой. Общий метаболический объем опухоли при постановке диагноза имеет также прогностическое значение.
Трепанобиопсия подвздошной кости с морфологией костного мозга остается обязательной процедурой, независимо от результатов ПЭТ/КТ, так как поражение костного мозга выявляется в 15–20% случаев ДВККЛ.
Оценку ответа по окончании лечения предпочтительно проводить посредством ПЭТ/КТ, с интерпретацией результатов по 5-балльной шкале Довиля, при этом результат в 1–3 балла считается показателем полного метаболического ответа. Определение циркулирующей опухолевой ДНК расценивается как многообещающий метод для промежуточной оценки ответа.
После завершения терапии пациенты должны проходить клиническое обследование каждые 3 месяца в течение 2 лет, затем каждые 6–12 мес. Выживаемость без событий в течение 2 лет с момента постановки диагноза почти аналогична выживаемости в общей популяции, соответствующей возрасту. Однако следует наблюдать пациентов на предмет долгосрочных рисков, включая поздние инфекционные осложнения, аутоиммунные нарушения, вторичные опухоли и сердечно-сосудистые осложнения.
Определение риска раннего прогрессирования
Основным клиническим инструментом как для стратификации пациентов, так и для прогнозирования исходов остается шкала (индекс) IPI/МПИ8.
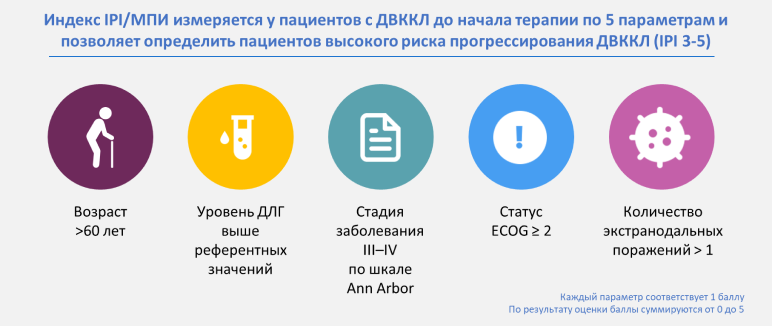
Рецидив ДВККЛ с поражением ЦНС является крайне неблагоприятным событием, встречающимся у 3–5% пациентов. У 60% пациентов рецидив с поражением ЦНС выявляется в ранние сроки после завершения терапии, что свидетельствует о вероятном скрытом поражении ЦНС уже при постановке диагноза. Медиана ОВ при таком сценарии составляет менее 6 мес. Роль профилактики вовлечения ЦНС, включающей системные химиопрепараты, проникающие через гематоэнцефалический барьер, остается противоречивой. Тем не менее высокодозный метотрексат активно применяется.
Заключение
Точный диагноз гетерогенной ДВККЛ необходим для выбора адекватного персонифицированного лечения, способного излечить большинство пациентов с минимальными токсическими проявлениями или вообще без них. В настоящее время стратификация вариантов ДВККЛ зависит от комбинации морфологических, иммунофенотипических и цитогенетических/ молекулярных исследований.
Полная диагностика подразумевает применение высокоточных методов, поэтому крайне важен поэтапный отбор случаев, требующих дополнительного молекулярного анализа, для оптимизации времени и ресурсов и обеспечении при этом оптимального ведения пациентов.
Клинические исследования помогают оптимизировать доступные инструменты стратификации и прогноза, и возможности оказания эффективной помощи пациентам с ДВККЛ. Эта работа еще не завершена, но поскольку ДВККЛ остается заболеванием «одного выстрела», оно требует достижения полной стойкой ремиссии в результате 1-й линии терапии, что не может быть реализовано без полноценной адекватной диагностики в каждом отдельном случае. В большинстве случаев 1-й линия терапии при ДВККЛ включает стандартную химиоиммунотерапию по схеме R-CHOP (ритуксимаб, циклофосфамид, доксорубицин, винкристин и преднизолон). Однако учитывая гетерогенность заболевания, адекватный ответ на стандартную терапию достигается у порядка 60% пациентов и зависит от возраста, прогноза по IPI, молекулярного подтипа по COO и наличия / отсутствия специфических хромосомных перестроек и экспрессии генов. Что говорит о нецелесообразности единого терапевтического подхода для пациентов с впервые выявленной ДВКЛ и необходимости стратификации больных для выбора оптимальной терапии первой линии.
Список литературы:
- Swerdlow SH, Campo E, Harris NL, et al. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Revised 4th ed. International Agency for Research on Cancer. Lyon, France, 2017; p. 2. National Cancer Institute. Surveillance, Epidemiology, and End Results (SEER) Program. https://seer.cancer.gov/.
- National Cancer Institute. Surveillance, Epidemiology, and End Results (SEER) Program. https://seer.cancer.gov/.
- Liu Y, Barta SK. Diffuse large B-cell lymphoma: 2019 update on diagnosis, risk stratification, and treatment. Am J Hematol. 2019;94(5):604-16. DOI:10.1002/ajh.25460.
- Li S, Young KH, Medeiros LJ. Diffuse large B-cell lymphoma. Pathology.2018;50(1):74-87. DOI:10.1016/j.pathol. 2017.09.006.
- Поддубная И.В., Паровичникова Е.Н., Каприн А.Д., Ковригина А.М. Российские клинические рекомендации «Агрессивные нефолликулярные лимфомы – диффузная крупноклеточная В-клеточная лимфома, первичная медиастинальная В-клеточная лимфома, лимфома Беркитта» 2022.
- Johnson NA, Slack GW, Savage KJ, et al. Concurrent expression of MYC and BCL2 in diffuse large B-cell lymphoma treated with rituximab plus cyclophosphamide, doxorubicin, vincristine, and prednisone. J Clin Oncol. 2012;30(28):3452-9. DOI:10.1200/JCO.2011.41.0985.
- Chapuy B, Stewart C, Dunford AJ, et al. Molecular subtypes of diffuse large B cell lymphoma are associated with distinct pathogenic mechanisms and outcomes. Nat Med. 2018;24(5):679-90. DOI:10.1038/s41591-018-0016-8.
- The International Non-Hodgkin’s Lymphoma Prognostic Factors Project. A predictive model for aggressive non-Hodgkin’s lymphoma. N Engl J Med. 1993;329(14):987-94. DOI:10.1056/NEJM199309303291402.

