Информация, размещенная в настоящем материале, содержит сведения о незарегистрированных в РФ лекарственных средствах/показаниях, носит исключительно научный характер и не является рекламой

Комплексное геномное профилирование при раке легкого: цели, средства, результат
Введение
За последнее столетие карцинома легкого превратилась из редкого заболевания во второй по распространенности вид рака в мире и самую частую причину смерти от рака1. Это наиболее распространенный вид рака у мужчин и второй по частоте – у женщин. В 2020 году было зарегистрировано 2 206 771 новых случаев РЛ2.
Стандартизированный по возрасту кумулятивный пожизненный риск диагностирования заболевания составляет 3,8% у мужчин и 1,77% у женщин3. Наиболее высокую распространенность заболевание имеет в странах, где распространено курение сигарет, – в Китае, большей части Восточной Европы, Ближнего Востока, Юго-Восточной Азии и России3.
Около 10–15% случаев РЛ составляет мелкоклеточный рак (МКРЛ). В 85–90% случаев развивается НМРЛ, включающий несколько подтипов: аденокарциному, плоскоклеточную и крупноклеточную карциному, карциноид4. Лечение и прогноз заболевания во многом зависят от типа опухоли, а также ранней диагностики.
Согласно современным представлениям, рак, в том числе и РЛ – это не гомогенная патология, а совокупность сотен заболеваний. Каждое из них имеет уникальные геномные характеристики, на которые может быть направлено терапевтическое вмешательство5.
Ответ на современную цитотоксическую терапию в последние годы достиг плато в разрезе скорости терапевтического ответа и выживаемости пациентов. К потенциальным достижениям в контроле и лечении РЛ ведет развитие технологии КГП, которая помогает понять молекулярные основы развития НМРЛ4.
Введение
Генетическое тестирование на мутации EGFR, ALK, ROS1 входит в стандарты диагностики и лечения пациентов с распространенным НМРЛ. В последнее время, с появлением новых эффективных иммуно- и таргетных методов лечения и открытием возможностей идентификации целевых факторов, широкое применение нашел метод CGP6.
CGP – методика, позволяющая анализировать значительное количество генов в образце опухоли. Анализ проводится с помощью метода секвенирования нового поколения (NGS), которое позволяет быстро и точно секвенировать большие объемы ДНК или РНК. В рамках CGP можно идентифицировать различные геномные изменения, включая точечные мутации, вставки и делеции в нескольких генах в одном образце. Кроме того, исследуемые геномные изменения могут включать вариабельность числа копий, перестройки/слияния генов, мутации в микросателлитах и общее количество соматических мутаций (нагрузка опухолевых мутаций)7. Исследование также позволяет характеризовать генетические изменения, которые не могут быть обнаружены с помощью анализов на основе одного гена или ПЦР. Все эти данные могут иметь важное значение для диагностики, терапии и прогноза рака, в том числе РЛ.
С открытием геномных изменений, которые можно идентифицировать с помощью методики секвенирования нового поколения, многие пациенты могут стать потенциальными кандидатами для таргетной терапии РЛ8.
В то же время стандартное молекулярное диагностическое тестирование НМРЛ чаще всего проводится с использованием традиционного диагностического тестирования или диагностического тестирования NGS «горячих точек», что ограничивает количество онкогенных факторов, которые могут быть идентифицированы9. Кроме того, традиционные молекулярно-диагностические тесты, использующие подход с тестированием одного гена, требуют времени из-за последовательного тестирования, которое истощает ограниченные образцы опухолевой ткани. Тесты на основе КГП используют секвенирование нового поколения для идентификации полной длины кодирующих регионов в сотнях генов с минимальными требованиями к ткани. В результате могут быть идентифицированы дополнительные мишени для лечения таргетными препаратами, иммунопрепаратами, а также мишени, позволяющие включить пациента в клинические исследования.
Исследования подтвердили возможность рутинного КГП у пациентов с аденокарциномой легкого для выбора оптимальной индивидуализированной терапии. Показано, что КГП сопряжено с более высокими показателями соответствия эффективной терапии и мутации в клинических исследованиях а также с более высоким показателем ответа на лечение9. Кроме того, обнаружено, что у пациентов с активирующими мутациями, получающих соответствующую таргетную терапию, медиана выживаемости значительно выше по сравнению с теми, кто не получает таргетные препараты8.
Было выявлено, что пациенты с активирующими мутациями EGFR или любым онкогенным драйвером имеют больший риск развития ассоциированной с радиотерапией пневмонией и и/или эзофагита по сравнению с пациентами без соответствующих мутаций.
В исследовании под руководством Kewen He10 было проведено комплексное геномное профилирование 474 биоптатов у пациентов с неоперабельным РЛ III стадии после химио- и радиотерапии. Анализ генетических характеристик пациентов позволил установить связь между изменениями в генах пути KEAP1-NRF2 и неблагоприятным прогнозом. Кроме того, были выявлены новые потенциальные факторы риска неблагоприятного исхода после химио- и радиотерапии, в том числе на основании обнаруженных изменений в генах семейств FGFR, MET, PTEN и NOTCH2 (рис. 1).
Рисунок 1. Генетические особенности, связанные с выживаемостью после химиотерапии: А – выживаемость без прогрессирования, В – общая выживаемость10
В работе, опубликованной в мае 2022 года в журнале Frontiers in Oncology11, изучалось влияние КГП на процесс принятия решений при лечении распространенного НМРЛ с транслокацией гена ALK у пациентов, не ответивших на терапию ингибиторами тирозинкиназ ALK 2/3 поколений. По данным исследования, КГП, проведенное во время прогрессирования заболевания на фоне применения ИТК ALK 2 и 3 поколений, позволило изменить рекомендации по терапии у 1/3 пациентов, что можно считать клинически значимым результатом. В случаях, когда начало лечения откладывалось до получения результатов КГП, доля пациентов, у которых изменились рекомендации по лечению, была еще выше (около 50%), что указывает на потенциально большее влияние геномной оценки на процесс принятия решений.
Важно отметить, что среднее время ожидания результатов тестирования составило всего 2,9 недель (межквартильный диапазон 2,4–4,4).
Рисунок 2. Время до прекращения лечения (А) и общая выживаемость (В) у пациентов с НМРЛ, у которых решение о терапии было принято до (группа 2) и после (группа 1) получения результатов КГП11
Таким образом, КГП, позволяя определить уникальные генетические изменения, может быть важным инструментом для принятия решений о персонализированном лечении РЛ, отслеживания изменений в геноме во время терапии, мониторинга течения заболевания и ответа на лечение, исследования новых терапевтических целей и улучшения понимания биологии рака в целом.

Мутационная нагрузка при раке легкого (TMB)
Новым прогностическим биомаркером для отбора пациентов для терапии ингибиторами ИКТ стал показатель мутационной нагрузки (Tumor mutational burden (TMB)). Как правило, его определяют как общее количество соматических кодирующих мутаций и связывают с появлением неоантигенов, запускающих противоопухолевый иммунитет12.
Высокая ТМВ типична для опухолей, которые развились в результате воздействия сильнодействующих канцерогенов, таких как табачный дым и полициклические ароматические углеводороды, в том числе при раке легкого12.
В последние годы интерес к ТMB со стороны исследователей и врачей существенно возрос, поскольку опухоли с высоким показателем мутационной нагрузки могут быть более чувствительными к терапии ингибиторами ИКТ, что связано с присущей данным видам опухолей повышенной иммуногенностью.
Напомним, что показатели ответа на монотерапию ингибиторами ИКТ остаются низкими (около 20%) в неселективных популяциях пациентов при большинстве типов рака, в то время как стоимость этих методов лечения высока13. Биомаркеры, которые позволяют отобрать пациентов с наиболее высоким прогнозируемым терапевтическим ответом на терапию препаратами этой группы, остаются критической потребностью для клинического ведения онкопациентов.
Эффективный противоопухолевый иммунный ответ требует распознавания поверхностного антигена опухолевых клеток с последующим праймированием и активацией иммунных клеток, что в конечном счете может способствовать уничтожению раковых клеток12.
Исследование, опубликованное в 2020 году в журнале Cureus14, показало, что пациенты с высокой ТMB, скорее всего, получат пользу от иммунотерапии и будут иметь более выраженный терапевтический ответ, клиническое преимущество и более длительную безрецидивную выживаемость при лечении ингибиторами ИКТ. Активность иммунотерапии у пациентов с полным терапевтическим ответом, по данным этого исследования, могла сохраняться после двух лет лечении.
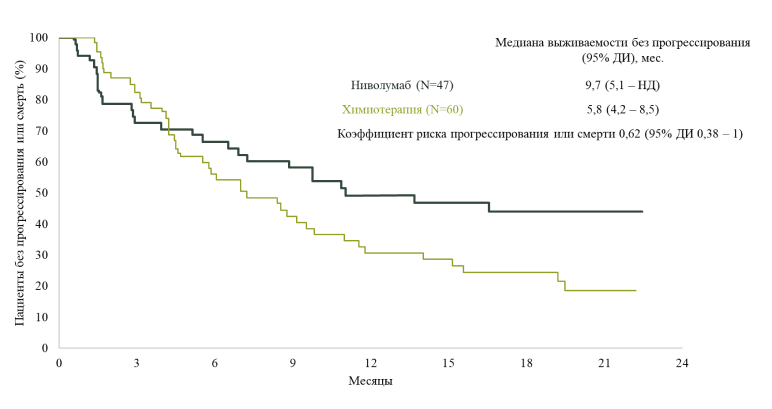
С более полным терапевтическим ответом у пациентов с высоким ТMB может быть связан уровень экспрессии PD–L1. Это подтверждают результаты исследования D.P. Carbone и соавт., опубликованного в журнале NEJM в 2017 году16. В этой работе показано, что пациенты с раком легкого с высоким ТMB и уровнем экспрессии PD–L1 50% или выше, вероятно, имеют более высокие шансы ответить на ингибитор ИКТ ниволумаб, чем те, кто имеет только один из этих факторов или ни одного из них. Среди пациентов с высокой ТMB ниволумаб был связан с более высоким уровнем терапевтического ответа по сравнению с химиотерапией (47% против 28%) и с более длительным средним временем до прогрессирования (9,7 против 5,8 месяцев) (рис.3).
Рисунок 3. Выживаемость без прогрессирования с высокой мутационной нагрузкой, получающих ниволумаб и химиотерапию16
Первоначальный стандартный подход к оценке ТMВ включал секвенирование полного генома соответствующих образцов с использованием технологии секвенирования нового поколения для сопоставленных образцов опухолевой ткани и нормальных образцов. Однако секвенирование полного генома требует высокого покрытия – примерно 50 Мб геномного контента17, что в настоящее время является дорогостоящим для рутинного клинического использования в онкологии. Кроме того, срок выполнения секвенирования полного генома составляет в среднем 4–6 недель. Поэтому были разработаны целевые, более экономичные и простые в исследовании панели секвенирования нового поколения .
Комплексное геномное профилирование анализирует 324 гена, связанные с раком, и использует алгоритмы для определения ТMB. Для анализа используются образцы ткани опухоли, полученные при биопсии или во время хирургического вмешательства. Из них извлекают ДНК, и, используя секвенирование нового поколения, определяют последовательности генов. Полученные данные анализируют с использованием специализированных алгоритмов и баз данных для идентификации мутаций в генах. ТMB определяется как количество соматических, кодирующих замен пар оснований и вставок или делений на 1 мегабазу (Mб) генома опухоли. Это число обычно выражают в мутациях на мегабазу. Результаты предоставляются в отчете, включающем ТMB и другую важную информацию, в частности данные об идентифицированных мутациях генов и возможных вариантах терапии для пациента (рис. 4).
Применение комплексного геномного профилирования у пациентов с РЛ описывают ряд исследований. Так, Matthew D. Hellmann и соавт. в открытом исследовании III фазы, опубликованном в NEJM в 2018 году13, оценивали эффективность ниволумаба или схем терапии, включающих ниволумаб, в качестве терапии первой линии у пациентов, отобранных с помощью КГП. На основании имеющихся данных, связанных с мутационной нагрузкой опухоли, в протокол исследования была добавлена первичная точка, оценивающая выживание без прогрессирования у пациентов с мутационной нагрузкой не менее 10 мутаций на мегабазу, независимо от уровня экспрессии PD–L1, получавших ниволумаб + ипилимумаб против химиотерапии. По результатам исследования, через 1 год выживания без прогрессирования в группе ниволумаб + ипилимумаб составило 42,6% против 13,2% в группе химиотерапии. Медиана выживания без прогрессирования составила 7,2 месяца по сравнению с 5,5 месяцами соответственно.
Рисунок 4. Рабочий процесс Комплексного геномного профилирования18
Эти данные соответствуют результатам многоцентрового исследования, опубликованного в журнале Oncotarget в 2022 году19. В исследовании участвовали пациенты с НМРЛ IV стадии, которым провели геномное профилирование с помощью методик комплексного геномного профилирования (64%). У пациентов, прошедших тестирование в начале лечения и получавших первую линию иммунотерапии с ТMB > 10, были отмечены более длительная общая выживаемость (ОР: 0.43, 95% ДИ: 0.21-0.88, p = 0.02) и безрецидивная выживаемость (ОР: 0.43, 95% ДИ: 0.21-0.85, p = 0.02).

Влияние мутаций на чувствительность к иммунотерапии у пациентов с раком легкого
Открытие ИКТ и последующая разработка ингибиторов этой мишени, отмеченная Нобелевской премией, произвели революцию в лечении РЛ, в частности, НМРЛ. Ингибиторы ИКТ блокируют белки, предотвращающие атаку иммунных клеток на клетки опухоли. Наиболее частые мишени – белок, связанный с программированной клеточной гибелью-1 (PD-1) и его лиганд PD–L1, а также антиген-4 цитотоксических лимфоцитов (CTLA-4). Ингибирование обеспечивает праймирование и противоопухолевую активность цитотоксических Т-клеток, которые в противном случае ингибируются за счет B7-1/2 и PD-L1, экспрессируемых антигенпрезентирующими клетками20.
Множество клинических исследований III фазы, проведенных в последние годы, продемонстрировали устойчивый терапевтический ответ и повышение общей выживаемости на фоне терапии ингибиторами ИКТ в сочетании с препаратами платины, что быстро расширило возможности лечения первой линии для пациентов с распространенным НМРЛ, которые являются носителями мутаций EGFR и транслокации ALK. Выбор терапии в клинической практике в значительной степени определяется экспрессией PD–L1, тяжестью заболевания и профилем опухолевых мутаций20.
Несмотря на растущую роль иммунотерапии, в частности, ингибирования контрольных точек PD-1/PD-L1 при РЛ, значительное число пациентов не отвечают на эти методы лечения, а у части пациентов возникают иммуноопосредованные токсические эффекты21,22. С учетом этого крайне важно определить клинически полезные прогностические биомаркеры для надлежащего выбора пациентов, которые с наибольшей вероятностью получат пользу, и для исключения пациентов с низкой вероятностью терапевтического ответа и/или повышенным риском токсичности.
Предсказывать ответ организма на иммунотерапию могут мутации в определенных генах.
Так, некоторые исследования предполагают, что наличие мутации KRAS может предсказать более высокие показатели ответа на иммунотерапию. Напомним, данные мутации, наряду с изменениями EGFR, являются наиболее частым типом изменений у пациентов с НМРЛ (около 25%)2. Они выявляются практически только при аденокарциноме легкого и связаны с курением23. В отличие от других типов РЛ, в KRAS-мутированных опухолях часто возникают дополнительные геномные изменения. Наиболее распространенные ко-мутации включают ТР53 (опухолевый белок р53), STK11 (серин/треонинкиназа 11) и KEAP1 (келч-подобный белок, ассоциированный с ECH). Учитывая отсутствие таргетной терапии, у пациентов с данными генетическими изменениями широко изучаются возможности иммунотерапии. В исследовании IMMUNOTARGET24 было показано, что наибольшая доля частичных или полных ответов на иммунотерапию наблюдалась именно у пациентов с мутацией KRAS.
В небольшом исследовании с участием 38 пациентов25 было показано, что в группе пациентов с мутацией KRAS, получавших иммунотерапию, контроль над заболеванием, выживаемость без прогрессирования и общая выживаемость были выше, чем в группе пациентов с диким типом онкогена KRAS.
С улучшенным ответом на иммунотерапию при раке легкого могут быть связаны мутации в гене TP53, особенно у пациентов с PD–L1-негативной аденокарциномой26, а также у пациентов с мутацией MET в экзоне 14. Описан случай успешного лечения РЛ у 48-летнего пациента с мутацией METex14, получавшего комбинацию ниволумаба и химиотерапии27.
За исключением геномных драйверных мутаций, PD-L1 является единственным биомаркером, рекомендованным NCCN для принятия решений о лечении метастатического НМРЛ (20). Прогностическую способность этого биомаркера продемонстрировали ряд исследований28-30.
Так, в исследовании Roy S. Herbst и соавт., опубликованном в 2016 году в The Lancet (28), была подтверждена важность использования PD-L1 как биомаркера для выбора пациентов с распространенным НМРЛ для лечения пембролизумабом. Результаты продемонстрировали, что препарат является новым вариантом лечения для пациентов с уровнем PD-L1 не менее 1%, получавших одну или более предыдущих линий лечения. Применение препарата было ассоциировано с повышением общей выживаемости, выживаемости без прогрессирования по сравнению с теми, кто получал доцетаксел.
Экспрессию PD–L1 можно рассматривать как подходящий биомаркера для терапии атезолизумабом – это продемонстрировали результаты мета-анализа Liu W. И соавт., опубликованного в 2022 году в Sec. Cancer Immunity and Immunotherapy31. В этой работе продемонстрировано, что полное понимание связи между экспрессией PD–L1 и терапевтическим эффектом атезолизумаба способствует лучшему выбору терапевтических схем и оптимизации персонализированной терапии.
Уровень экспрессии PD-L1 может не только помочь в отборе пациентов, но и предсказать выраженность терапевтического ответа. В двойном слепом исследовании III фазы KEYNOTE-18930 была продемонстрирована связь между общей выживаемостью и выживаемостью без прогрессирования и PD–L1-статусом опухоли. Наибольшее преимущество имели пациенты с экспрессией PD-L1 с показателем доли опухоли 50% и выше (рис. 5).
Рисунок 5. Общая выживаемость в зависимости от экспрессии PD-L1 с показателем доли опухоли (TPS): А – менее 1%, В – 14-49%, С – более 50%30
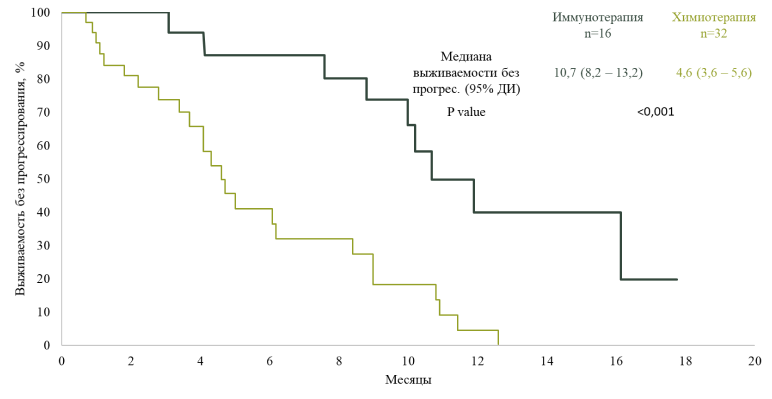
Ряд мутаций может быть связан с худшим ответом на иммунотерапию. В недавнем исследовании китайских ученых32 были получены данные о том, что иммунотерапия в комбинации с химиотерапией может играть роль в первичном лечении пациентов с НМРЛ, у которых обнаружены вставки в экзоне 20 (ex20ins) генов EGFR и HER2 (рис. 6). Эти мутации являются относительно редкими и обычно связаны с меньшей чувствительностью к классическим ИТК, что ограничивает эффективность первичного лечения.
Рисунок 6. Выживаемость без прогрессирования у пациентов в группах иммунотерапии и химиотерапии с НМРЛ со вставками в экзоне 20 EGFR и HER232
С худшим ответом на иммунотерапию могут быть связаны мутации в гене STK11. Так, в исследовании L. Raez и соавт.33 было показано, что пациенты с НМРЛ стадии IIIB-IV с данной мутацией имели более низкую медиану выживаемости без прогрессирования и общей выживаемости по сравнению с пациентами без мутации STK11. Есть данные о мутации PIK3СА как предикторе низкого ответа на иммунотерапию34.
В исследовании IMMUNOTARGET24 ретроспективно изучали эффективность монотерапии ингибиторами ИКТ у пациентов с РЛ с онкогенными драйверными мутациями. Результаты показали, что в группе пациентов с мутацией ALK (n=23) не наблюдалось ответа на иммунотерапию, в группе с мутацией EGFR (n=125) общий процент ответа составил 12%, а среди пациентов с ROS1 (n=7) – 16%. Эти результаты подтверждены в исследовании Gainor и соавт.35, показавшем, что среди 28 пациентов с мутациями EGFR или ALK ответ на иммунотерапию был получен только у 1 пациента, в то время как среди пациентов с диким типом EGFR и отрицательным/неизвестным статусом ALK – у 7 из 30 пациентов.
Соответствуют результатам исследования IMMUNOTARGET и данные, полученные Choudhury и соавт.36. В этом исследовании оценивался ответ на иммунотерапию у пациентов с НМРЛ и перестройкой гена ROS1 как в составе монотерапии (n=28), так и в комбинации с химиотерапией (n=11). Время до прекращения лечения у пациентов, получавших иммунотерапию, составило 2,1 месяца, а у пациентов на комбинации химиотерапии и иммунотерапии достигло 10 месяцев, что является выдающимся результатом. Таким образом, в этой работе было продемонстрировано, что в большинстве случаев ROS1-реаранжированных НМРЛ активность иммунотерапии умеренная, в то время как комбинация иммунотерапии и химиотерапии может достичь значимого терапевтического ответа. Сегодня активно исследуются и другие молекулярные маркеры, которые могут представлять собой важные новые цели для иммунотерапии РЛ, такие как CTLA-437.
Эти результаты подтверждают важность широкой молекулярной диагностики НМРЛ для подбора пациентов с наиболее вероятным и, напротив, с низким терапевтическим ответом на иммунотерапию и демонстрируют перспективы этого метода лечения у пациентов с НМРЛ.

Клинические исходы при назначении таргетной терапии у пациентов с редкими мутациями в раке легкого
Решающее значение в лечении распространенного рака легкого имеет подбор терапии с наибольшими шансами на терапевтический ответ и оптимальную переносимость. Этой цели можно достичь при корректном подборе как иммунотерапии, так и таргетной терапии. Таргетные препараты воздействуют на известную молекулярную мишень, большинство которых экспрессируются внутри раковых клеток или на них. Однако некоторые мишени, в частности, фактор роста эндотелия сосудов VEGF и рецепторы VEGF (VEGFR) экспрессируются в микроокружении опухоли или строме38.
Наличие мишени может определяться до начала терапии путем исследования образцов опухоли с помощью гистологических и молекулярных методов или предполагаться на основании предшествующего анализа большого количества образцов39.
Рисунок 7. Молекулярные мишени НМРЛ40
Подсчитано, что более 65% пациентов с распространенным НМРЛ имеют потенциально направленные на мишени для таргетной терапии изменения в геноме41 (рис. 7). С появлением таргетной терапии прогноз пациентов с НМРЛ значительно улучшился, а серия клинических исследований показала, что выживаемость без прогрессирования у пациентов, получающих таргетные препараты, воздействующие на онкогенные участки, значительно увеличилась по сравнению с пациентами на химиотерапии42.
Применение таргетной терапии является стандартом лечения подгрупп пациентов с распространенных НМРЛ с мутациями EGFR, транслокациями ALK и ROS1.
Возможно, лечение пациентов с НМРЛ с мутацией EGFR является лучшим примером того, как таргетная терапия изменила парадигму лечения РЛ.
Активирующие мутации EGFR – наиболее распространенные таргетные мутации при аденокарциноме легкого, для которых существует несколько зарегистрированных ИТК. В клинических исследованиях показаны значительно более высокие выживаемость без прогрессирования, объективная частота ответа и качество жизни у пациентов, получающих ИТК, по сравнению с пациентами с мутацией EGFR на химиотерапии43.
Реаранжировка гена EML4-ALK при аденокарциноме легкого – еще один яркий пример того, как обнаружение таргетного генетического изменения опухоли может привести к улучшению лечения НМРЛ. Ингибитор мультикиназ первого поколения кризотиниб был одобрен в качестве стандартной терапии вскоре после демонстрации превосходства над химиотерапией в условиях первой линии43.
На лечение ингибитором протеинкиназы алектинибом реагирует большинство пациентов с ALK-положительным НМРЛ. По данным мета-анализа восьми исследований с участием 626 пациентов показатель контроля заболевания у пациентов, получавших алектиниб, составил 88%, общий коэффициент ответа 70%44.
Сегодня активно изучаются и более редкие генетические изменения, которые могут быть мишенями для таргетной терапии рака легких. Ген ROS1, мутации которого обнаруживаются у 1–2% пациентов с распространенным НМРЛ, принадлежит к семейству тирозинкиназ рецепторов инсулина и становится постоянно активированным из-за хромосомных перестроек, что приводит к активации сигнальных путей PI3K-AKT, RAS-MAPK и STAT3. Эти онкогенные слияния объединяют домен киназы ROS1 с несколькими известными партнерами слияния, что приводит к аномальной локализации ROS1 и клеточной трансформации43 .
Сайты связывания ROS1 и ALK имеют на 77% аминокислотную гомологию. Исходя из этого структурного сходства, традиционные ингибиторы ALK показали эффективность в лечении НМРЛ с мутацией ROS1. Так, в исследовании с участием 50 пациентов с НМРЛ44, было показано, что частота объективных ответов у пациентов с НМРЛ с мутацией ROS-1, получавших кризотиниб, составила 72%, средняя продолжительность ответа – 17,6 месяцев, а медиана выживаемости без прогрессирования – 19,2 месяцев. На основании этих данных FDA утвердило использование кризотиниба как препарата первой линии у пациентов с НМРЛ и перестройкой ROS1.
По мере получения новых знаний о молекулярном ландшафте НМРЛ, в значительной степени вторичного по отношению к усовершенствованиям в методах комплексного молекулярного профилирования, продолжают появляться редкие, но клинически действенные драйверы. Изучается применение ИТК, ингибирующих слияния RET/ROS/NTRK или повышенную активность MET/AXL43.
Было изучено применение ряда мультикиназных ингибиторов у пациентов с РЛ с транслокацией RET. Напомним, мутации гена RET, кодирующего рецепторную тирозинкиназу, которая активирует сигнальные пути RAS/MAPK, PI3K/AKT и JAK/STAT, обнаруживается у 1% с РЛ42. Независимые исследователи продемонстрировали, что мультикиназные ингибиторы RET активны in vitro и in vivo в отношении различных моделей РЛ с реаранжировкой RET45,46. Эти данные были подтверждены в исследовании II фазы, показавшем клиническую противоопухолевую активность ИТК вандетаниба у пациентов с распространенным НМРЛ с реаранжировкой RET и определившим перестройку RET как новую молекулярную подгруппу НМРЛ, подходящую для таргетной терапии47.
Согласно результатам многоцентрового исследования ARROW, проведенного в 13 странах мира, ИТК пралсетиниб продемонстрировал высокую активность у пациентов с НМРЛ с транслокацией RET: терапевтический ответ был зарегистрирован у 61% пациентов (95% ДИ 50–71%, n=87), ранее получавших химиотерапию препаратами платины, включая 6% пациентов с полным ответом и у 70% пациентов, ранее не получавших терапии (ДИ 50–86%, n=27), включая 11% пациентов с полным ответом48. Также подтверждена активность селперкатиниба у пациентов с RET-положительным НМРЛ – как у тех, кто ранее получал химиотерапию на основе препаратов платины, так и у тех, кто ранее не лечился48 (рис.8).
Рисунок 8. Длительность терапевтического ответа (А) и выживаемости без прогрессирования (В) у пациентов с RET-положительным НМРЛ, получающих селперкатиниб49
В последние годы в качестве мишени для таргетной терапии изучаются мутации гена нейротрофического рецептора тирозинкиназы NTRK, играющего роль в онкогенезе более 20 злокачественных новообразований, в т.ч. НМРЛ. Первые доказательства клинической пользы при НМРЛ с мутацией NTRK были получены в отношении ИТК ларотректиниба. Результаты были представлены на Всемирной конференции 2018 года по раку легких. На тот момент у четырех пациентов, получавших препарат, сохранялся постоянный терапевтический ответ (в диапазоне от 5,7 до 12 месяцев)50.
В рамках исследований I и II фазы была показана эффективность мощного ингибитора тирозинкиназ ROS1 и TRKA/B/C энтректиниба у пациентов с различными солидными опухолями с транслокациями NTRK, в том числе с НМРЛ51. Результаты показали, что терапия энтректинибом позволила уменьшить объем опухоли более чем у половины пациентов с местнораспространенными или метастатическими опухолями с транслокациями NTRK (частота объективного ответа 63,5%, N=74). На основании этих данных Европейская комиссия выдала условное разрешение на применение энтректиниба у взрослых и детей от 12 лет с солидными опухолями с перестройками генов NTRK при наличии локальных или отдаленных метастазов, а также в случаях, когда хирургическая резекция может привести к тяжелым осложнениям, которые раньше не получали лечение NTRK-ингибиторами или при отсутствии приемлемой альтернативной терапии.
Редкой, но потенциально действенной мишенью для таргетной терапии могут быть слияния NRG1 и FGFR36.
Рисунок 9.Таргетные препараты, одобренные FDA для лечения НМРЛ36
В будущем, судя по всему, разработка новых таргетных препаратов для лечения НМРЛ будет ускоряться, что связано с лучшим пониманием молекулярной гетерогенности НМРЛ и более широким клиническим использованием геномного профилирования. Глубокое секвенирование онкогенных драйверов, такое как КГП, может выявить дополнительные молекулярные цели, связанные с реакцией и резистентностью к терапии и с новыми мишенями. Это позволит разработать методы лечения с более высокой селективностью и специфичностью для определенных мишеней.
Растущее число активных исследований фазы II/III показывает многообещающие результаты в борьбе с лекарственной устойчивостью и широкие возможности для открытия новых таргетных препаратов, что делает таргетную терапию потенциально мощным оружием для лечения распространенных форм НМРЛ.

Определение генетических изменений с помощью КГП: прошлое, настоящее, будущее
По прогнозам, в ближайшем будущем, благодаря достижениям персонализированной медицины, количество онкологических заболеваний, поддающихся медикаментозному лечению, возрастет до более чем 40%, и среди таких видов рака – НМРЛ52. Одна из важнейших задач персонализированной медицины связана с молекулярным тестированием. К тому же все больше клинических исследований зарубежом отбирают пациентов на основе новых биомаркеров, поскольку они имеют высокую вероятность успеха (52).
На сегодняшний день разработан ряд панелей для комплексного геномного профилирования и продемонстрированы преимущества некоторых методик по сравнению с другими методами тестирования18,52, 53.
Так, в исследовании под руководством SM Ali52 было показано, что определение мутаций с помощью комплексного геномного профилирования позволило выявить ряд генетических изменений, которые не удалось обнаружить при секвенировании методом “горячих точек”. Более того, с помощью комплексного геномного профилирования удалось выявить генетические изменения, на которые можно было воздействовать терапевтически одобренной или оцениваемой в клинических исследованиях противоопухолевой терапией. По данным этого же исследования53, по крайней мере 85% опухолей (n=310) содержали как минимум одно генетическое изменение, на которое можно воздействовать лекарственными препаратами, а в 68% опухолей (n=248) была обнаружена минимум одна мутация, пропущенная секвенированием методом “горячих точек”.
В исследовании, опубликованном Coren A. Milbury и соавт.18, подтверждена возможность КГП предоставлять ценную информацию, которая может влиять на принятие решения о лечении рака. Более чем в 191 000 отчетах, предоставленных с 2018 по 2020 год, показано, что методика позволяет выявить потенциальные терапевтические мишени лечения рака. Из более чем 36000 отчетов о лечении НМРЛ:
- около 50% содержали данные о терапии, которая была связана с сопутствующей диагностикой
- около 70% подтверждали принятие решения о терапии, одобренной для данного типа опухоли
- около 80% описывали случаи принятия решений о терапии, доступной при опухоли других типов.
Почти все отчеты включали как минимум одно соответствующие клиническое исследование.
Немаловажно, что широкопанельное геномное профилирование связано с уровнем включения в клинические исследования в зарубежных странах от 10% до 20%, в то время как в среднем этот показатель составляет всего около 8%53.
Предварительные экономические анализы показали, что клинические преимущества КГП могут сопровождаться лишь незначительным увеличением затрат по сравнению с другими методами молекулярного тестирования и при этом более длительным периодом эффективной терапии для пациентов и значительным увеличением длительности жизни53.

Заключение
Перспективы персонализированной терапии злокачественных новообразований заключаются в возможности адаптировать варианты лечения к уникальным особенностям конкретного пациента. Для их реализации решающее значение имеет качество диагностического теста. Высококачественное исследование может точно определить биомаркеры и предсказать потенциальный ответ на терапию с использованием клинически проверенного подхода.
Результаты множества исследований подтверждают, что КГП предоставляет ценную информацию, которая позволяет принимать важные решения о лечении злокачественных новообразований.
Методика имеет большой потенциал улучшения результатов для пациентов и может быть экономически эффективной. С учетом увеличения понимания биологии рака, в том числе РЛ, судя по всему, проведение высококачественных проверенных молекулярных тестов в ближайшие годы выйдет на первый план как терапевтически и экономически эффективный подход к лечению онкологических заболеваний по сравнению с традиционной эмпирической терапией.
Вам может быть интересно:
Информация, размещенная в настоящем материале, содержит сведения о незарегистрированных в РФ лекарственных средствах/показаниях, носит исключительно научный характер и не является рекламой

РЛ – рак легкого; МКРЛ – мелкоклеточный рак легкого; НМРЛ – немелкоклеточный рак легкого; КГП – комплексное геномное профилирование; ПЦР – полимеразная цепная реакция; ИТК – ингибитор тирозинкиназы; ИКТ – иммунные контрольные точки; ОР – отношение рисков; ДИ – доверительный интервал.
Ссылки:
- de Groot PM, Wu CC, Carter BW, Munden RF. The epidemiology of lung cancer. Transl Lung Cancer Res [Internet]. 2018 Jun 1 [cited 2023 Jul 4];7(3):220. Available from: /pmc/articles/PMC6037963/
- Lung cancer statistics [Internet]. Available from: https://www.wcrf.org/cancer-trends/lung-cancer-statistics/
- Thandra KC, Barsouk A, Saginala K, Aluru JS, Barsouk A. Epidemiology of lung cancer. Contemp Oncol Onkol [Internet]. 2021 [cited 2023 Jul 4];25(1):45–52. Available from: https://doi.org/10.5114/wo.2021.103829
- Nigro E, Imperlini E, Scudiero O, Monaco ML, Polito R, Mazzarella G, et al. Differentially expressed and activated proteins associated with non small cell lung cancer tissues. Respir Res [Internet]. 2015 Jun 24 [cited 2023 Jul 4];16(1):1–10. Available from: https://respiratory-research.biomedcentral.com/articles/10.1186/s12931-015-0234-2
- An algorithm for more accurate identification of cancer-associated mutations in genome sequencing studies. Sci Exch 2013 627 [Internet]. 2013 Jul [cited 2023 Jul 4];6(27):699–699. Available from: https://link.springer.com/article/10.1038/scibx.2013.699
- Zhao S, Zhang Z, Zhan J, Zhao X, Chen X, Xiao L, et al. Utility of comprehensive genomic profiling in directing treatment and improving patient outcomes in advanced non-small cell lung cancer. BMC Med [Internet]. 2021 Dec 1 [cited 2023 Jul 4];19(1):1–10. Available from: https://link.springer.com/articles/10.1186/s12916-021-02089-z
- Basharat S, Farah K. An overview of comprehensive genomic profiling technologies to inform cancer care. Can J Heal Technol. 2022;2(8):2–19.
- Liu L, Liu J, Shao D, Deng Q, Tang H, Liu Z, et al. Comprehensive genomic profiling of lung cancer using a validated panel to explore therapeutic targets in East Asian patients. Cancer Sci [Internet]. 2017 Dec 1 [cited 2023 Jul 4];108(12):2487–94. Available from: https://onlinelibrary.wiley.com/doi/full/10.1111/cas.13410
- Signorovitch J, Zhou Z, Ryan J, Anhorn R, Chawla A. Budget impact analysis of comprehensive genomic profiling in patients with advanced non-small cell lung cancer. J Med Econ [Internet]. 2019 Feb 1 [cited 2023 Jul 4];22(2):140–50. Available from: https://www.tandfonline.com/doi/abs/10.1080/13696998.2018.1549056
- He K, Zhang S, Pang J, Yin JC, Mu D, Wang J, et al. Genomic Profiling Reveals Novel Predictive Biomarkers for Chemo-Radiotherapy Efficacy and Thoracic Toxicity in Non-Small-Cell Lung Cancer. Front Oncol. 2022 Jul 14;12:928605.
- Raphael A, Onn A, Holtzman L, Dudnik J, Urban D, Kian W, et al. The Impact of Comprehensive Genomic Profiling (CGP) on the Decision-Making Process in the Treatment of ALK-Rearranged Advanced Non-Small Cell Lung Cancer (aNSCLC) After Failure of 2nd/3rd-Generation ALK Tyrosine Kinase Inhibitors (TKIs). Front Oncol. 2022 May 13;12:874712.
- Lawlor RT, Mattiolo P, Mafficini A, Hong SM, Piredda ML, Taormina S V., et al. Tumor mutational burden as a potential biomarker for immunotherapy in pancreatic cancer: Systematic review and still-open questions. Cancers (Basel) [Internet]. 2021 Jul 1 [cited 2023 Jul 5];13(13):3119. Available from: /pmc/articles/PMC8269341/
- Truesdell J, Miller VA, Fabrizio D. Approach to evaluating tumor mutational burden in routine clinical practice. Transl lung cancer Res [Internet]. 2018 Dec 1 [cited 2023 Jul 5];7(6):678–81. Available from: https://pubmed.ncbi.nlm.nih.gov/30505712/
- Maung TZ, Ergin HE, Javed M, Inga EE, Khan S. Immune Checkpoint Inhibitors in Lung Cancer: Role of Biomarkers and Combination Therapies. Cureus [Internet]. 2020 May 13 [cited 2023 Jul 5];12(5). Available from: https://pubmed.ncbi.nlm.nih.gov/32542150/
- Cui Y, Liu X, Wu Y, Liang X, Dai J, Zhang Z, et al. Deleterious AHNAK2 Mutation as a Novel Biomarker for Immune Checkpoint Inhibitors in Non-Small Cell Lung Cancer. Front Oncol. 2022 Mar 10;12:798401.
- Carbone DP, Reck M, Paz-Ares L, Creelan B, Horn L, Steins M, et al. First-Line Nivolumab in Stage IV or Recurrent Non-Small-Cell Lung Cancer. N Engl J Med [Internet]. 2017 Jun 6 [cited 2023 Jul 5];376(25):2415. Available from: /pmc/articles/PMC6487310/
- Nakagawa H, Fujita M. Whole genome sequencing analysis for cancer genomics and precision medicine. Cancer science. 2018;109(3):513-522.
- Milbury CA, Creeden J, Yip WK, Smith DL, Pattani V, Maxwell K, et al. Clinical and analytical validation of FoundationOne®CDx, a comprehensive genomic profiling assay for solid tumors. PLoS One [Internet]. 2022 Mar 1 [cited 2023 Jul 9];17(3):e0264138. Available from: https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0264138
- Willis C, Bauer H, Au TH, Menon J, Unni S, Tran D, et al. Real-world survival analysis by tumor mutational burden in non-small cell lung cancer: a multisite U.S. study. Oncotarget [Internet]. 2022 Jan 1 [cited 2023 Jul 5];13:257–70. Available from: https://www.oncotarget.com/article/28178/text/
- Mamdani H, Matosevic S, Khalid AB, Durm G, Jalal SI. Immunotherapy in Lung Cancer: Current Landscape and Future Directions. Front Immunol. 2022 Feb 9;13:823618.
- Suresh K, Naidoo J, Lin CT, Danoff S. Immune Checkpoint Immunotherapy for Non-Small Cell Lung Cancer: Benefits and Pulmonary Toxicities. Chest. 2018 Dec 1;154(6):1416–23.
- Camidge DR, Doebele RC, Kerr KM. Comparing and contrasting predictive biomarkers for immunotherapy and targeted therapy of NSCLC. Nat Rev Clin Oncol 2019 166 [Internet]. 2019 Feb 4 [cited 2023 Jul 6];16(6):341–55. Available from: https://www.nature.com/articles/s41571-019-0173-9
- Friedlaender A, Drilon A, Weiss GJ, Banna GL, Addeo A. KRAS as a druggable target in NSCLC: Rising like a phoenix after decades of development failures. Cancer Treat Rev. 2020 Apr 1;85:101978.
- Mazieres J, Drilon A, Lusque A, Mhanna L, Cortot AB, Mezquita L, et al. Immune checkpoint inhibitors for patients with advanced lung cancer and oncogenic driver alterations: results from the IMMUNOTARGET registry. Ann Oncol. 2019 Aug 1;30(8):1321–8.
- Torralvo J, Friedlaender A, Achard V, Addeo A. The Activity of Immune Checkpoint Inhibition in KRAS Mutated Non-small Cell Lung Cancer: A Single Centre Experience. Cancer Genomics Proteomics [Internet]. 2019 Nov 1 [cited 2023 Jul 6];16(6):577–82. Available from: https://europepmc.org/articles/PMC6885372
- Olivares-Hernández A, del Barco Morillo E, Miramontes-González JP, Figuero-Pérez L, Pérez-Belmonte L, Martín-Vallejo J, et al. Immunohistochemical Assessment of the P53 Protein as a Predictor of Non-Small Cell Lung Cancer Response to Immunotherapy. Front Biosci - Landmark [Internet]. 2022 Mar 1 [cited 2023 Jul 6];27(3):88. Available from: https://www.imrpress.com/journal/FBL/27/3/10.31083/j.fbl2703088/htm
- Chen Z, Feng Z#, Li C, Li J, Cheng B, Xiong S, et al. Non-small cell lung cancer with MET exon 14 skipping alteration responding to immunotherapy: a case report. Ann Transl Med [Internet]. 2021 Mar [cited 2023 Jul 6];9(5):424–424. Available from: https://atm.amegroups.com/article/view/64301/html
- Herbst RS, Baas P, Kim DW, Felip E, Pérez-Gracia JL, Han JY, et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): A randomised controlled trial. Lancet [Internet]. 2016 Apr 9 [cited 2023 Jul 6];387(10027):1540–50. Available from: http://www.thelancet.com/article/S0140673615012817/fulltext
- Garon EB, Rizvi NA, Hui R, Leighl N, Balmanoukian AS, Eder JP, et al. Pembrolizumab for the Treatment of Non–Small-Cell Lung Cancer. N Engl J Med [Internet]. 2015 May 21 [cited 2023 Jul 6];372(21):2018–28. Available from: https://www.nejm.org/doi/full/10.1056/nejmoa1501824
- Gandhi L, Rodríguez-Abreu D, Gadgeel S, Esteban E, Felip E, De Angelis F, et al. Pembrolizumab plus Chemotherapy in Metastatic Non–Small-Cell Lung Cancer. N Engl J Med [Internet]. 2018 May 31 [cited 2023 Jul 6];378(22):2078–92. Available from: https://www.nejm.org/doi/full/10.1056/NEJMoa1801005
- Zhang M, Huang Q, Yu M, Xue J, Huang M, Lu Y, et al. Immunotherapy for non-small cell lung cancer with EGFR or HER2 exon 20 insertion mutations: a real-world analysis. Transl Lung Cancer Res [Internet]. 2023 Apr 4 [cited 2023 Jul 6];12(4):797–807. Available from: /pmc/articles/PMC10183400/
- Raez L, Uba R, North A, Dumais K, Powery H, Domingo G, et al. P33.14 STK11/LKB1, KRAS Mutations and Immune-Related Adverse Events as Predictors of Response to Immunotherapy in Lung Cancer. J Thorac Oncol [Internet]. 2021 Mar 1 [cited 2023 Jul 6];16(3):S411. Available from: http://www.jto.org/article/S1556086421007255/fulltext
- Kauffmann-Guerrero D, Tufman A, Kahnert K, Bollmann BA, Reu S, Syunyaeva Z, et al. Response to Checkpoint Inhibition in Non-Small Cell Lung Cancer with Molecular Driver Alterations. Oncol Res Treat [Internet]. 2020 Jun 8 [cited 2023 Jul 6];43(6):289–98. Available from: https://dx.doi.org/10.1159/000506842
- Gainor JF, Shaw AT, Sequist L V., Fu X, Azzoli CG, Piotrowska Z, et al. EGFR mutations and ALK rearrangements are associated with low response rates to PD-1 pathway blockade in non-small cell lung cancer: A retrospective analysis. Clin Cancer Res [Internet]. 2016 Sep 15 [cited 2023 Jul 6];22(18):4585–93. Available from: https://dx.doi.org/10.1158/1078-0432.CCR-15-3101
- Choudhury NJ, Schneider JL, Patil T, Zhu VW, Goldman DA, Yang SR, et al. Response to Immune Checkpoint Inhibition as Monotherapy or in Combination With Chemotherapy in Metastatic ROS1-Rearranged Lung Cancers. JTO Clin Res Reports. 2021 Jul 1;2(7):100187.
- Guo H, Zhang J, Qin C, Yan H, Liu T, Hu H, et al. Biomarker-Targeted Therapies in Non–Small Cell Lung Cancer: Current Status and Perspectives. Cells [Internet]. 2022 Oct 1 [cited 2023 Jul 8];11(20). Available from: /pmc/articles/PMC9600447/
- Larsen JE, Cascone T, Gerber DE, Heymach J V., Minna JD. Targeted Therapies for Lung Cancer: Clinical Experience and Novel Agents. Cancer J [Internet]. 2011 Nov [cited 2023 Jul 7];17(6):512. Available from: /pmc/articles/PMC3381956/
- Savas P, Hughes B, Solomon B. Targeted therapy in lung cancer: IPASS and beyond, keeping abreast of the explosion of targeted therapies for lung cancer. J Thorac Dis [Internet]. 2013 [cited 2023 Jul 7];5(Suppl 5):S579. Available from: /pmc/articles/PMC3804878/
- Ai X, Guo X, Wang J, Stancu AL, Joslin PMN, Zhang D, et al. Targeted therapies for advanced non-small cell lung cancer. Oncotarget [Internet]. 2018 Dec 1 [cited 2023 Jul 10];9(101):37589–607. Available from: https://pubmed.ncbi.nlm.nih.gov/30680072/
- Cheng Y, Zhang T, Xu Q. Therapeutic advances in non-small cell lung cancer: Focus on clinical development of targeted therapy and immunotherapy. MedComm [Internet]. 2021 Dec 1 [cited 2023 Jul 7];2(4):692–729. Available from: https://onlinelibrary.wiley.com/doi/full/10.1002/mco2.105
- Xiao Y, Liu P, Wei J, Zhang X, Guo J, Lin Y. Recent progress in targeted therapy for non-small cell lung cancer. Front Pharmacol [Internet]. 2023 [cited 2023 Jul 7];14. Available from: /pmc/articles/PMC9994183/
- Halliday PR, Blakely CM, Bivona TG. Emerging Targeted Therapies for the Treatment of Non-small Cell Lung Cancer. Curr Oncol Rep [Internet]. 2019 Mar 1 [cited 2023 Jul 7];21(3):1–12. Available from: https://link.springer.com/article/10.1007/s11912-019-0770-x
- Shaw AT, Ou S-HI, Bang Y-J, Camidge DR, Solomon BJ, Salgia R, et al. Crizotinib in ROS1 -Rearranged Non–Small-Cell Lung Cancer . N Engl J Med [Internet]. 2014 Nov 20 [cited 2023 Jul 7];371(21):1963–71. Available from: https://www.nejm.org/doi/full/10.1056/nejmoa1406766
- Fan J et al. The efficacy and safety of alectinib in the treatment of ALK+ NSCLC: a systematic review and meta-analysis. OncoTargets and therapy; 2018:1105-1115.
- Lipson D, Capelletti M, Yelensky R, Otto G, Parker A, Jarosz M, et al. Identification of new ALK and RET gene fusions from colorectal and lung cancer biopsies. Nat Med 2012 183 [Internet]. 2012 Feb 12 [cited 2023 Jul 8];18(3):382–4. Available from: https://www.nature.com/articles/nm.2673
- Kohno T, Ichikawa H, Totoki Y, Yasuda K, Hiramoto M, Nammo T, et al. KIF5B-RET fusions in lung adenocarcinoma. Nat Med 2012 183 [Internet]. 2012 Feb 12 [cited 2023 Jul 8];18(3):375–7. Available from: https://www.nature.com/articles/nm.2644
- Yoh K, Seto T, Satouchi M, Nishio M, Yamamoto N, Murakami H, et al. Vandetanib in patients with previously treated RET-rearranged advanced non-small-cell lung cancer (LURET): an open-label, multicentre phase 2 trial. Lancet Respir Med [Internet]. 2017 Jan 1 [cited 2023 Jul 8];5(1):42–50. Available from: http://www.thelancet.com/article/S2213260016303228/fulltext
- Gainor JF, Curigliano G, Kim DW, Lee DH, Besse B, Baik CS, et al. Pralsetinib for RET fusion-positive non-small-cell lung cancer (ARROW): a multi-cohort, open-label, phase 1/2 study. Lancet Oncol [Internet]. 2021 Jul 1 [cited 2023 Jul 8];22(7):959–69. Available from: http://www.thelancet.com/article/S1470204521002473/fulltext
- Drilon A, Oxnard GR, Tan DSW, Loong HHF, Johnson M, Gainor J, et al. Efficacy of Selpercatinib in RET Fusion–Positive Non–Small-Cell Lung Cancer . N Engl J Med [Internet]. 2020 Aug 27 [cited 2023 Jul 8];383(9):813–24. Available from: https://www.nejm.org/doi/full/
- Farago A, Kummar S, Ibabekci S, Corsi-Travali S, Cruickshank S, Cox M, et al. P1.13-40 Rapid, Robust and Durable Responses to Larotrectinib in Patients with TRK Fusion Non-Small Cell Lung Cancer. J Thorac Oncol [Internet]. 2018 Oct 1 [cited 2023 Jul 8];13(10):S597–8. Available from: http://www.jto.org/article/S1556086418318550/fulltext
- Doebele RC et al. Entrectinib in patients with advanced or metastatic NTRK fusion-positive solid tumours: integrated analysis of three phase 1–2 trials. The Lancet Oncology. 2020; 21(2):.271-282.
- Karol D, McKinnon M, Mukhtar L, Awan A, Lo B, Wheatley-Price P. The Impact of Foundation Medicine Testing on Cancer Patients: A Single Academic Centre Experience. Front Oncol. 2021 Jul 26;11:687730.
- Ali SM, Palma NA, Wang K, Ross JS, Stephens PJ, Yelensky R, et al. Clinical next generation sequencing (NGS) to reveal high frequency of alterations to guide targeted therapy in lung cancer patients. https://doi.org/101200/jco20133115_suppl8020. 2013 May 20;31(15_suppl):8020–8020.





