Вы являетесь медицинским работником? Для полного доступа к медицинской информации войдите или зарегистрируйтесь.
ЗСОНМ: вопросы патогенеза
В.С. Краснов о генетической составляющей предрасположенности к развитию заболеваний спектра оптиконевромиелита
Заболевание спектра оптиконевромиелита (ЗСОНМ) представляет из себя гетерогенную группу клинико-радиологических синдромов и включает в себя: AQP4-IgG-серопозитивные варианты, MOG-IgG-серопозитивные варианты, AQP4-IgG и MOG-IgG-серонегативные варианты1. Около 75% пациентов с ЗСОНМ имеют AQP4-IgG [Wingerchuk DM et al., 2015]. Пациентов, имеющих клинико-радиологическую картину, которая не противоречит критериям диагностики AQP4-IgG -серонегативных вариантов ЗСОНМ2 c MOG-IgG в сыворотке крови в случаях, когда и патоморфологические особенности у этой группы больных могут рассматриваться как миелинопатия3, по современным научным данным следует рассматривать как имеющих абсолютно другое заболевание4. В данной публикации мы обсудим патогенез AQP4-IgG-серопозитивных вариантов ЗСОНМ, которые представляют из себя астроцитопатии5.
Владимир Сергеевич Краснов
к.м.н., доцент кафедры неврологии ФГБОУ ВО «Первый Санкт-Петербургский государственный
медицинский университет имени академика И.П. Павлова» Минздрава России.
Механизмы развития AQP4-IgG и MOG-IgG-серонегативных вариантов однозначно не определены. Патогенез ЗСОНМ сложен. Вероятно, присутствует генетическая предрасположенность к развитию заболевания, которая отлична от рассеянного склероза6. Одним из наиболее часто упоминаемых аллелей, с которым ассоциируется повышенный риск развития ЗСОНМ, является DRB1*03 аллель гена HLA (англ., Human Leucocyte Antigen)7. Основные звенья патогенеза AQP4-IgG-серопозитивных вариантов ЗСОНМ включают в себя:
- активацию В-клеточного звена иммунитета и выработку антител (АТ) к аквапорину-4 (AQP4),
- дисфункцию гемато-энцефалического барьера (ГЭБ),
- активацию системы комплемента,
- повышенную продукцию провоспалительного цитокина ИЛ-6 с развитием каскада иммунопатологических реакций,
- изменения в системе Т-клеточного звена иммунитета (увеличение соотношения Тх17/Трег),
- привлечение в очаг воспаления клеток врожденного иммунитета (натуральных киллеров, НФ, ЭО),
- повышение активности тучных клеток8.
Важную регуляторную роль в развитии иммунопатологического ответа играют мембранные гликопротеины — кластеры дифференцировки (CD)9.
Аквапорины (AQP) – белки, которые играют ключевую роль в регуляции трансцеллюлярного потока воды в ряде органов. AQP4 — основной аквапорин, экспрессируемый в мозге. Различают его изоформы М1 и М2310, патогенетическая роль каждой из них в развитии заболевания точно не определена, но связывание AQP4-IgG c M23 изоформой приводит к более значимой активации системы комплемента11. AQP4 расположены преимущественно в периваскулярных ножках астроцитов, которые участвуют в формировании ГЭБ, в глиальных пограничных мембранах головного, спинного мозга (СМ), зрительных нервов. AQP4 обнаружены в области «слабого» ГЭБ в области хиазмы, вокруг желудочков (периэпиндемально), в местах входа корешков в СМ, гипоталамуса. Именно эти области могут быть первой мишенью для АТ к AQP412.
Экспрессия AQP4 присутствует в клетках собирательных трубочек почек, кардиомиоцитах, эпителии дыхательных путей, клетках ободочной кишки, тонкого кишечника, париетальных клетках желудка, поперечно-полосатых мышечных волокнах13. Однако аутоиммунного ответа против них не развивается, так как в различных органах присутствуют мембранные гликопротеины (CD) – ингибиторы формирования мембранного атакующего комплекса (МАК). В частности, в почках есть CD46, СD55, в желудке СD46, в скелетных мышцах CD46. В астроцитах in vitro выявлялся CD59, однако, в культуре клеток «астроцит-эндотелий» его нет. Таким образом, ингибиторы комплемента различных органов, в отличие от CD 59 астроцитов, защищают периферические органы от AQP4-IgG. Увеличение активности CD59 c целью ингибирования МАК является одним из направлений терапии ЗСОНМ14.
Повышение проницаемости ГЭБ при ЗСОНМ рассматривается как потенциальный прогностический биомаркер для оценки тяжести течения и клиническим особенностям ЗСОНМ. Пациенты с ЗСОНМ и повышенной проницаемостью ГЭБ демонстрировали более высокий балл EDSS, титр AQP4-IgG, уровень белка и лейкоцитов в ликворе, уровень основного белка миелина и С3 компонента комплемента по сравнению с пациентами с ЗСОНМ и нормальным его состоянием.
Повышенная секреция матриксной металлопротеиназы (ММP) и сосудистого клеточного адгезионного протеина -1 (VCAM-1) отмечается у пациентов с ЗСОНМ независимо от титра AQP4-IgG в сыворотке крови15.
Последовательность иммунопатологических событий в патогенезе AQP4-IgG-серопозитивных вариантов ЗСОНМ представляется следующим образом. В результате повреждения ГЭБ, в образовании которого принимают участие астроциты, происходит стимуляция рецепторов повреждения астроцитов. Затем запускается цепочка иммунопатологических процессов, которая в конечном итоге заканчивается презентацией антигена в шейных лимфоузлах с последующей выработкой AQP4-IgG. Нельзя исключить, что первичная выработка AQP4-IgG происходит на антигены вне ЦНС, которые затем перекрестно связываются с AQP4 ЦНС. После проникновения AQP4-IgG через ГЭБ и связывания их c AQP4 на ножках астроцитов и формирования комплекса антиген (АГ)-антитело (АТ) происходит активация комплемента по его классическому пути с реализацией механизмов комплемент-опосредованной цитотоксичности. Формирование комплекса AQP4 (АГ) — AQP4-IgG (АТ) также приводит к активации натуральных киллеров и реализации механизмов антитело-зависимой цитотоксичности.
Повреждение астроцитов приводит к высвобождению цитокинов поврежденными астроцитами, которые вместе с компонентами активированного комплемента способствуют к привлечению в очаг воспаления нейтрофилов (НФ), эозинофилов (ЭО), макрофагов (МФ), увеличению проницаемости ГЭБ для AQP4-IgG.
Дегрануляция НФ, ЭО способствует дальнейшему повреждению астроцитов. В конечном итоге отмечается вторичное повреждение олигодендроцитов (ОДЦ), нарушается целостность миелиновой оболочки, повреждаются аксоны, формируется со временем гиперплазия сосудистой стенки и гиалинизация артериол16. Основные звенья патогенеза представлены на Рис.117.
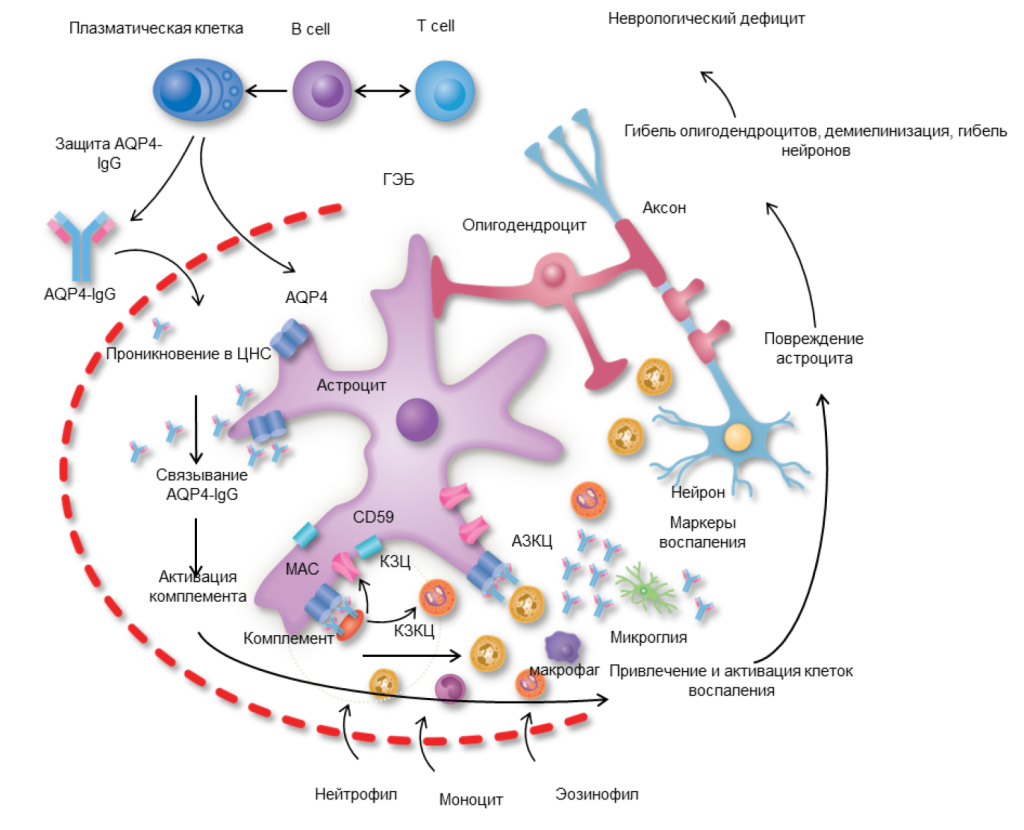
Патоморфологические изменения, выявляемые в зонах структурных изменений в ЦНС, включают потерю астроцитами AQP4, демиелинизацию, аксональное повреждение, периваскулярные депозиты AQP4-IgG, компоненты активированного комплемента, макрофагальную инфильтрацию, активацию микроглии, воспалительную инфильтрацию гранулоцитами (ЭО, НФ, БФ)18. Нарушение транспорта воды в ЦНС в результате повреждения AQP4 вносят самостоятельный вклад в деструктивный при ЗСОНМ в очагах воспаления19.
Особую роль в патогенезе ЗСОНМ имеет повышенная продукция провоспалительного цитокина ИЛ-6 с развитием каскада иммунопатологических реакций. ИЛ-6 вырабатывается в очаге воспаления различными типами клеток, наиболее важными из которых являются макрофаги и моноциты. Основные источники ИЛ-6 в ЦНС обнаружены в нейронах, астроцитах, микроглии и эндотелиальных клетках. При их повреждении все они могут секретировать высокие уровни ИЛ-620. Основные эффекты ИЛ-6, реализуемые через его растворимые и мембраносвязанные рецепторы, при ЗСОНМ продемонстрированы на рис.2
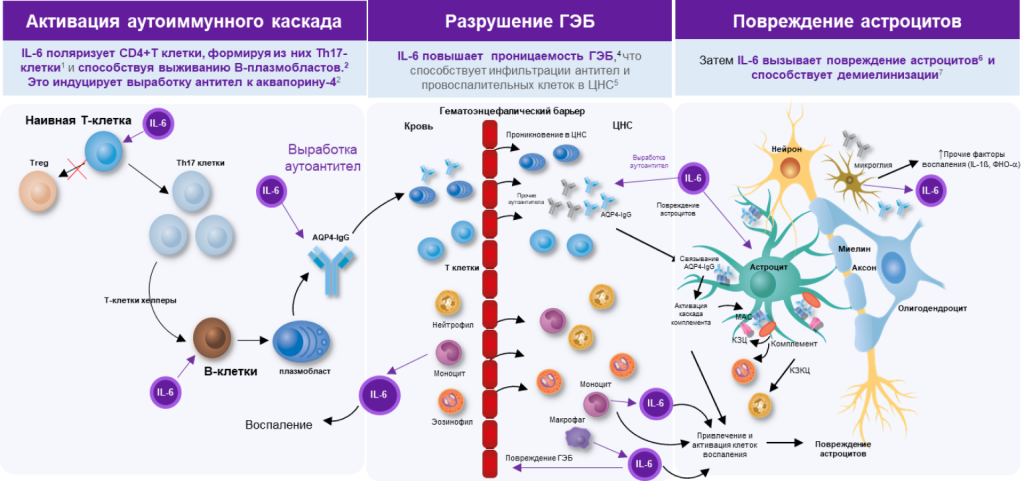
ИЛ-6 индуцирует активность B-клеток, повышая выработку AQP4-IgG, а также увеличивает выживаемость плазмобластов. ИЛ-6 в сочетании с другим цитокином ТФР-β (трансформирующий фактор роста бета) способствует дифференцировке наивных CD4+ T-клеток в сторону Tх17, при этом ИЛ-6 ингибирует индуцированное TФР-β образование Tрег клеток21. Развившийся в результате дисбаланс Tх17>Tрег может вызвать начало и прогрессирование аутоиммунных и хронических воспалительных заболеваний22, в том числе ЗСОНМ, при котором под влиянием ИЛ-6 еще и увеличивается в периферической крови число плазмобластов23. ИЛ-6 повышает проницаемость ГЭБ, связываясь со своими рецепторами на эндотелии, способствуя поддержанию аутоиммунных воспалительных процессов в нервной системе24. Повышенная продукция ИЛ-6 происходит при ЗСОНМ как вне ЦНС, так и интратекально (макрофаги, моноциты, астроциты, микроглия).
В последнее время удалось достичь больших успехов в изучении патогенеза ЗСОНМ, что способствовало появлению лекарственных средств, воздействующих на различные его звенья. Одним из самых перспективных направлений терапии ЗСОНМ представляет из себя блокирование патологических эффектов ИЛ-6, которое реализуется благодаря действию препарата Сатрализумаб25.
AQP4 – аквапорин-4; AQP4-IgG – антитела к аквапорину-4; MOG-IgG – антитела к миелин-олигодендроцитарному гликопротеину; НФ – нейтрофилы; ИЛ-6 – интерлейкин-6; ТФР- β — трансформирующий фактор роста бета
Список литературы:
- Whittam D, Wilson M., Hamid S., Keir G., Bhojak M., Jacob A. What’s new in neuromyelitis optica? A short review for clinical neurologist. J Neurol.2017;264(11):2330-2344
- Weinshenker BG, Wingerchuk DM Neuromyelitis spectrum disorders. Mayo Clin Proc. April 2017; 92(4): 663-679
- Wingerchuk DM, Banwell B, Bennett JL et al. International consensus diagnostic criteria for neuromyelitis optica spectrum disorders. Neurology 2015; 85:177-89
- Jarius S., Paul F., Aktas O. et al. MOG encephalomyelitis: international recommendations on diagnosis and antibody testing // J Neuroinflammation.- 2018.-Vol.15.- P.134.
- Blanco Y, Ercilla-González G, Llufriu S et al. HLA-DRB1 typing in Caucasians patients with neuromyelitis optica] Rev Neurol. 2011 Aug 1;53(3):146-52
- Guimaraães BD., Barreira A., dos Santos A. et al. HLA-DRB association in neuromyelitis optica is different from that observed in multiple sclerosis // Multiple Sclerosis Journal. – 2009. – № 16 (1). – Р. 21–29
- Wu Y, Zhong L, Geng J. Neuromyelitis optica spectrum disorder: Pathogenesis, treatment, and experimental modelsMult Scler Relat Disord. 2019 Jan;27:412-418.
- Saadoun S, Papadopoulos M. Role of membrane complement regulators in neuromyelitis optica. Multiple Sclerosis Journal. 2015;21(13):1644-1654
- Nagelhus EA, Ottersen OP. Physiological roles of aquaporin-4 in brain. Physiol Rev. 2013 Oct;93(4):1543-62
- Hinson SR, Romero MF, Popescu BFG et al. Molecular outcomes of neuromyelitis optica (NMO)-IgG binding to aquaporin-4 in astrocytes. Proceedings of the National Academy of Sciences. 2011; 109(4):1245-50
- Papadopoulos MC, Verkman AS. Aquaporin water channels in the nervous system. Nat Rev Neurosci. 2013 Apr;14(4):265-77
- Wingerchuk DM et al. The spectrum of neuromyelitis optica Lancet Neulol 2007; 6: 805-815
- Day RE1, Kitchen P2, Owen DS et al. Human aquaporins: regulators of transcellular water flow. Biochim Biophys Acta. 2014 May;1840(5):1492-506
- Chen B1, Qin C1, Tao R et al. The clinical value of the albumin quotient in patients with neuromyelitis optica spectrum disorder. Mult Scler Relat Disord. 2019 Dec 2;38:101880. doi: 10.1016/j.msard.2019.101880. [Epub ahead of print]
- You X1, Yan L1, Li X Disruption of blood-brain barrier integrity associated with brain lesions in Chinese neuromyelitis optica spectrum disorder patients. Mult Scler Relat Disord. 2019 Jan;27:254-259
- Wang Y1, Zhu M1, Liu C1 Blood Brain Barrier Permeability Could Be a Biomarker to Predict Severity of Neuromyelitis Optica Spectrum Disorders: A Retrospective Analysis. Front Neurol. 2018 Aug 7;9:648. doi: 10.3389/fneur.2018.00648. eCollection 2018.
- Tasaki A1, Shimizu F, Sano Y Autocrine MMP-2/9 secretion increases the BBB permeability in neuromyelitis optica. J Neurol Neurosurg Psychiatry. 2014 Apr;85(4):419-30
- Levin MH, Bennett JL, Verkman AS. Optic neuritis in neuromyelitis optica Prog Retin Eye Res. 2013 Sep; 36: 159–171.
- Tradrantip L., Jin BJ, Yao X et al. Aquporin-targeted therapeutics: state-of-the-field. Adv.Exp.Med.Biol.2017;969:239-250.
- Tanaka T, Kishimoto T. Targeting interleukin-6: all the way to treat autoimmune and inflammatory diseases. Int J Biol Sci. 2012;8(9):1227-36. doi: 10.7150/ijbs.4666. Epub 2012 Oct 24.
- Papadopoulos MC, Bennett JL, Verkman AS et al. Treatment of neuromyelitis optica: state-of-the-art and emerging therapies Nat Rev Neurol. 2014 September ; 10(9): 493–506. doi:10.1038/nrneurol.2014.141.
- Erta M, Quintana A, Hidalgo J. Interleukin-6, a major cytokine in the central nervous system. Int J Biol Sci. 2012;8(9):1254-66. doi: 10.7150/ijbs.4679. Epub 2012 Oct 25.
- Pittock SJ, Lucchinetti CF Neuromyelitis optica and the evolving spectrum of autoimmune aquaporin-4 channelopathies: a decade later Ann N Y Acad Sci. 2016 Feb;1366(1):20-39
- Iwanaga J, Takeshita Y, Matsushita Y et al. New BBB Model Reveals That IL-6 Blockade Suppressed the BBB Disorder, Preventing Onset of NMOSD. Surg Radiol Anat. 2021 Dec 2. doi: 10.1007/s00276-021-02862-y
- Инструкция по медицинскому применению лекарственного препарата Энспринг®Версия 1 МИНЗДРАВ РОССИИ ЛП-007335-300821

