Вы являетесь медицинским работником? Для полного доступа к медицинской информации войдите или зарегистрируйтесь.
Эволюция режимов применения ингибиторов ангиогенеза
Существующие подходы, плюсы и минусы, куда мы идём с появлением новых молекул?
Рост новообразованных сосудов глаза и нарушение их проницаемости являются одной из ведущих проблем в современной офтальмологии. Данный патологический процесс приводит к таким заболеваниям как неоваскулярная возрастная макулярная дегенерация (нВМД), диабетический макулярный отёк (ДМО), окклюзия вен сетчатки, хориоидальная неоваскуляризация (ХНВ) при осложненной миопии и другие. Развитие сосудистых поражений глаза влечет к нарушению зрительных функций вплоть до полной потери зрения, как у лиц пожилого, так и трудоспособного возраста, что ведёт к значительной социально-экономической нагрузке. На практике, традиционными методами лечения этого ряда заболеваний остаются: внутриглазное введение кортикостероидов, лазеркоагуляция сетчатки, витреоретинальная хирургия. Однако общепризнано, что данные методики позволяют лишь приостановить необратимую утрату зрения1.
В 2004 г. началась новая эра в лечении заболеваний глазной патологии. Этому значимому событию способствовало одобрение для применения в клинической практике первого ингибитора сосудистого эндотелиального фактора роста (VEGF) для лечения нВМД2. ВМД – многофакторное хроническое медленно прогрессирующие заболевание, которое вызывает снижение зрения вплоть до полной потери у людей старше 50 лет3. По мере старения населения распространенность ВМД во всем мире ежегодно увеличивается, и ожидается, что к 2040 году она достигнет 288 миллионов4. Различают неэкссудативную («сухую») и экссудативную, неоваскулярную («влажную») формы данной патологии. Неэкссудативная ВМД составляет около 90% случаев и характеризуется медленным прогрессированием. Экссудативная, или неоваскулярная форма, при которой происходит рост новообразованных сосудов хориоидеи, встречается в 10% случаев ВМД. Ключевым активатором неоваскуляризации является фактор роста эндотелия сосудов (vascular endothelial growth factor — VEGF), приводящий к аномальным ангиогенным процессам. Методом, изменившим направление в лечении неоваскулярной патологии, является интравитреальное введение ингибиторов VEGF фактора. На сегодняшний день в мировой практике применение ингибиторов ангиогенеза является «золотым» стандартом при нВМД.
Учитывая хронический характер заболевания, анти-VEGF терапия требует регулярных инъекций в соответствии с четкими временными интервалами. На начальном этапе предусмотрена фаза загрузки (loading doses — LD), состоящая из нескольких, чаще трех последовательных интравитреальных введений с промежутком в 1 месяц. Затем следует поддерживающая фаза, продолжающаяся в течение всей жизни больного. На данным момент остаётся дискутабельным вопрос подбора оптимального режима дозирования. Важнейшей задачей является повысить эффективность лечения, а также снизить нагрузку на пациента и лечащего врача в отношении частоты инъекций и мониторинговых визитов.
На данный момент имеется ряд основных режимов для анти-VEGF терапии.
1. Фиксированный режим — fixed regimen (FR)
Данный подход подразумевает проведение инъекций препарата через фиксированный промежуток времени. В зависимости от интервала выделяют следующие варианты: ежемесячный, ежеквартальный, а также возможен вариант инъекций 1 раз в 2 месяца5.

Рост новообразованных сосудов глаза и нарушение их проницаемости являются одной из ведущих проблем в современной офтальмологии. Данный патологический процесс приводит к таким заболеваниям как неоваскулярная возрастная макулярная дегенерация (нВМД), диабетический макулярный отёк (ДМО), окклюзия вен сетчатки, хориоидальная неоваскуляризация (ХНВ) при осложненной миопии и другие. Развитие сосудистых поражений глаза влечет к нарушению зрительных функций вплоть до полной потери зрения, как у лиц пожилого, так и трудоспособного возраста, что ведёт к значительной социально-экономической нагрузке. На практике, традиционными методами лечения этого ряда заболеваний остаются: внутриглазное введение кортикостероидов, лазеркоагуляция сетчатки, витреоретинальная хирургия. Однако общепризнано, что данные методики позволяют лишь приостановить необратимую утрату зрения1.
дозирования, легкость планирования, максимально быстрый и устойчивый результат терапии. Однако данная схема имеет ряд существенных минусов, таких как риск недостаточного или избыточного лечения (в зависимости от избранного интервала), возможное развитие фиброза и атрофических процессов в центральном отделе сетчатки. Важно отметить, что основной принцип в использовании ежемесячных загрузочных интравитреальных инъекций сохранен в более современных режимах.
2. Режим с проведением инъекций анти-VEGF-препаратов по необходимости (Pro Re Nata — PRN)
Подразумевает ежемесячный мониторинг активизации ХНВ и выполнение инъекций в ответ на возобновление клинических проявлений заболевания. Представленная схема получила широкое распространение в клинической практике, благодаря индивидуальному подходу к терапии пациента6.
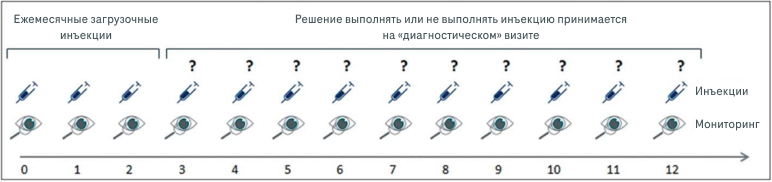
Особенностями режима с проведением инъекций по необходимости является то, что терапия почти не зависит от функциональных показателей, а определяется только морфологическими показателями сетчатки. Это обуславливает необходимость постоянного, в идеале — ежемесячного, наблюдения за пациентом, чтобы вовремя определить ухудшение и показание к инъекции. Основным преимуществом режима PRN, который стал первой попыткой реализовать персонализированный подход к терапии нВМД, является возможность уменьшить необходимое количество инъекций. Однако для достижения этой цели практически всегда приходится жертвовать эффективностью лечения5.
3. Режим наблюдения и планирования — Observe-and-Plan (O&P)
Предусматривает комбинирование принципов режимов FR и PRN. Согласно схеме O&P пациенту проводят первые 3 загрузочные инъекции с последующим ежемесячным наблюдением до выявления признаков возобновления активности ХНВ. Период наблюдения необходим для определения интервала, с которым будут проводиться последующие инъекции. Таким образом, после возобновления активности ХНВ дальнейшую серию инъекций анти-VEGF-препарата проводят с интервалом на 2 недели короче выявленного периода до возврата признаков заболевания7.

Имея проактивную составляющую FR-режима, схема наблюдение и планирование позволяет повысить эффективность проводимой терапии. С другой стороны, персонализированный компонент реактивного режима PRN, позволяющий снизить количество инъекций, предусматривает активацию ХНВ и персистенции экссудации. Сложность в реализации схемы O&P — необходимость в регулярном мониторинге и расчете нового интервала каждые 6 месяцев, что обусловливает его низкую распространенность8.
4. Режим лечить и увеличивать интервал — Treat and Extend (T&E)
Дальнейшие попытки оптимизировать подходы к проведению антиангиогенной терапии были направлены в сторону персонализации режимов назначения ИВИ. Персонализированные режимы, такие как «лечить и увеличивать интервал» («лечить и продлевать», Treat and Extend) включают проведение ежемесячных инъекций анти-VEGF-препаратов до исчезновения признаков активности заболевания. После стабилизации ХНВ в результате загрузочных инъекций последовательно увеличивают интервалы между ними, на 2 или 4 недели, до достижения возможного максимального промежутка в 16 недель. В случае возобновления активности заболевания интервал между интравитреальными введениями сокращают.
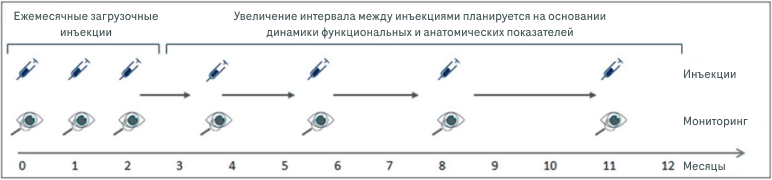
Главным преимуществом режима T&E является соблюдение принципа проактивного персонализированного лечения, который даёт возможность предупреждать рецидивы активности ХНВ в соответствии с индивидуальными особенностями пациента. Основное преимущество – возможность уменьшать количество инъекций без необходимости в дополнительном мониторинге состояния пациента между ними. Кроме того, значительно снижается вероятность как избыточного, так и недостаточного лечения.
Результатом несоблюдения схем антиангиогенной терапии является возобновление активности ХНВ и ухудшение структурных и функциональных показателей сетчатки. Очевидно, что длительный перерыв в лечении может сопровождаться необратимым снижением остроты зрения9-11. В эпоху карантинных мероприятий пациенты с хроническими заболеваниями наиболее чувствительны к вынужденному перерыву в терапии, который приводит к нарушению как фазы загрузки, так и фазы поддержания, выполняемые по различным схемам. В поисках оптимальных режимов наблюдения и лечения пациентов в условиях глобальной пандемии были предложены различные схемы ведения пациентов с нВМД, основанные на минимизации количества визитов в офтальмологические подразделения. Перед медицинскими организациями были поставлены и реализованы следующие задачи: сокращение времени визита пациента в лечебное учреждение для уменьшения времени контакта между пациентами и медицинскими работниками; уменьшение загруженности зон ожидания для обеспечения безопасного расстояния между пациентами; поддержание стабильного функционального и морфологического результатов лечения в течение всего периода наблюдения9.
Одна из таких схем ведения – «лечить и планировать» (treat and plan).
На практике, посещения лечебного учреждения делятся на диагностические визиты длительностью до 30 минут и визиты для выполнения интравитреальных инъекций (лечебные) длительностью до 15 минут. При диагностическом визите выполняется визометрия и определяется степень активности по данным оптической когерентной томографии. При этом сохраняется принципы проактивности с применением трёх нагрузочных доз. Повторное посещение для оценки и планирования лечения проводится через 4 недели после последней загрузочной инъекции. Во время приема оценивается активность заболевания, и пациенту соответственно назначается режим с фиксированным интервалом. Первая инъекция проводится сразу после подбора необходимой схемы во время одного и того же визита. В представленном режиме в зависимости от активности заболевания пациентам назначаются различные схемы с фиксированным интервалом: 3 × q4, 3 × q6, 3 × q8, 2 × q10 и 2 × q12 (количество инъекций × интервал в неделях)12. Учитывая вероятность рецидива период между диагностическими визитами, консультации назначаются не реже 1 раза в 6 месяцев9.
Существует еще один режим лечения – «трижды и планируй» (triple and plan).
После визита пациента, ранее не получавшего лечения, либо прервавшего терапию, в связи с карантинными ограничениями по COVID-19, назначаются 3 последовательные загрузочные инъекции и последующая оценка функциональных и морфологических параметров сетчатки. Важно, что инъекции планируются с интервалом 4 недели между первой и второй и 5 недель между второй и третьей. Если на 9-й неделе при контрольном визите отмечена положительная динамика, интервал между инъекциями следует увеличить до 1 недели. Таким образом, следует запланировать еще один курс из трех инъекций (5 недель между третьей и четвертой инъекцией, 5 недель между четвертой и пятой инъекцией и 6 недель между пятой и шестой инъекцией. Если при повторной оценке положительная динамика не отмечается, интервал инъекций следует сократить на 1 неделю с минимальным интервалом 4-4-5 недель между тремя запланированными инъекциями (недель между четвертой и пятой инъекцией и 6 недель между пятой и шестой инъекцией (5-5-6). По протоколу предусмотрено максимальное удлинение интервала до 8 (4+4) недель12.
Интравитреальные препараты, блокирующие VEGF представляют собой вариант лечения первой линии при нВМД и ДМО. Тем не менее, короткие интервалы между инъекциями выявили необходимость в разработке новых молекул, обеспечивающих более продолжительный эффект действующего вещества. В настоящее время идут разработки новых лекарственных препаратов с более высокой молярной концентрацией, которая способствует увеличению периода полувыведения вещества из глаза, что способствует его длительной циркуляции и продолжительному эффекту. Предложены новые формы доставки препарата, в частности разработана гидрогелевая форма лекарственного средства, также способствующая более длительной циркуляции активного вещества. Ведутся исследования, в которых совмещают применение анти-VEGF факторов и ингибиторов тиразинкиназы, способствующих замедлению разрушения молекулы анти-VEGF13. Актуальным направлением в антиангиогенном лечении является разработка продуктов генной терапии для непосредственной работы с клетками сетчатки [13]. Кроме того, альтернативой, позволяющей избежать интравитреальных инъекций у пациентов с сосудистыми заболеваниями сетчатки, являются портовые системы доставки, которые также могут обеспечить медленное высвобождение молекулы лекарственного средства14.
Важным достижением стала разработка инновационного механизма действия подразумевающего одновременное связывание и нейтрализацию с высокой эффективностью и специфичностью как ангиопоэтина-2 (Ang-2), так и VEGF-A. Антагонист Ang-2 снижает эффекты VEGF, уменьшает проницаемость сосудов и обладает противовоспалительной активностью13,15.
Таким образом, не останавливаясь на достигнутом, продолжаются разработки по повышению эффективности и доступности антиангиогенной терапии.
Список литературы
- Adamis A.P., Brittain C.J., Dandekar A., Hopkinset J.J. Building on the success of anti-vascular endothelial growth factor therapy: a vision for the next decade. Eye. 2020; 34 (11): 1966–1972.
- Курышева Н.И., Сергушев С.Г., Наумова В.И., Иванова А.А. Эволюция применения ингибиторов ангиогенеза в офтальмологии. Эффективная фармакотерапия. 2022; 18 (11): 58–67.
- Flaxel, C. J., Adelman, R. A., Bailey, S. T., Fawzi, A., Lim, J. I., Vemulakonda, G. A., et al. (2020). Age-Related Macular Degeneration Preferred Practice Pattern®. Ophthalmology 127, P1-p65. doi:10.1016/j.ophtha.2019.09.024
- Wang, F., Yuan, Y., Wang, L., Ye, X., Zhao, J., Shen, M., et al. (2019). One-Year Outcomes of 1 Dose versus 3 Loading Doses Followed by Pro Re Nata Regimen Using Ranibizumab for Neovascular Age-Related Macular Degeneration: The ARTIS Trial. J. Ophthalmol. 2019, 7530458. doi:10.1155/2019/7530458
- Astakhov Y.S., Nechiporenko P.A. Dosing regimens of angiogenesis inhibitors in the treatment of neovascular age-related macular degeneration patients // Ophthalmology Journal. — 2019. — Vol. 12. — N. 2. — P. 47-56. doi: 10.17816/OV2019247-56
- Garcia-Layana A, Figueroa MS, Araiz J et al. Treatment of Exudative Age-related Macular Degeneration:Focus on Aflibercept. Drugs Aging. 2015;32:797-807. https://doi.org/10.1007/s40266-015-0300-y
- Mantel I. Optimizing the Anti-VEGF Treatment Strategy for Neovascular Age-Related Macular Degeneration: From Clinical Trials to Real-Life Requirements. Transl Vis Sci Technol. 2015 Jun 8;4(3):6. doi: 10.1167/tvst.4.3.6. PMID: 26069865; PMCID: PMC4461215.
- Файзрахманов Р.Р. Режимы назначения анти-VEGF-препаратов при терапии неоваскулярной возрастной макулярной дегенерации. Вестник офтальмологии. 2018;134(6):107‑115. Fayzrakhmanov RR. Anti-VEGF dosing regimen for neovascular age-related macular degeneration treatment. Vestnik Oftalmologii. 2018;134(6):107‑115. (In Russ.). https://doi.org/10.17116/oftalma2018134061107
- Antaki, F. Treating neovascular age-related macular degeneration in the era of COVID-19 / F. Antaki, A. Dirani — Text: immediate // Graefe’s Archive for Clinical and Experimental Ophthalmology. — 2020. — Vol. 258, № 7. -P. 1567- 1569.
- Borrelli, E. Short-term outcomes of patients with neovascular exudative AMD: the effect of COVID-19 pandemic / E. Borrelli, D. Grosso, G. Vella [et al.]. — Text: immediate // Graefe’s Archive for Clinical and Experimental Ophthalmology. — 2020. — Vol. 258, № 12. — P. 2621-2628.
- Elfalah, M. Delayed intravitreal anti-VEGF therapy for patients during the COVID-19 lockdown: an ethical endeavor / M. Elfalah, S.A. AlRyalat, M.D. Toro 107 [et al.]. — Text: immediate // Clinical Ophthalmology. — 2021. — № 15. — P. 661- 669.
- Влияние пандемии COVID-19 на ведение пациентов с влажной формой возрастной макулярной дегенерации : автореферат дис. … кандидата медицинских наук : 3.1.5. / Харакозов Александр Сергеевич; [Место защиты: ФГБВОУ ВО «Военно-медицинская академия имени С.М. Кирова» Министерства обороны Российской Федерации]. — Санкт-Петербург, 2022. — 31 с.
- Hussain RM, Shaukat BA, Ciulla LM, Berrocal AM, Sridhar J. Vascular Endothelial Growth Factor Antagonists: Promising Players in the Treatment of Neovascular Age-Related Macular Degeneration. Drug Des Devel Ther. 2021 Jun 21;15:2653-2665. doi: 10.2147/DDDT.S295223. PMID: 34188445; PMCID: PMC8232378.
- Patel P., Sheth V. New and innovative treatments for neovascular age-related macular degeneration (nAMD) J. Clin. Med. 2021;10:2436. doi: 10.3390/jcm10112436.
- Eter N, Singh RP, Abreu F, Asik K, Basu K, Baumal C, Chang A, Csaky KG, Haskova Z, Lin H, Ruiz CQ, Ruamviboonsuk P, Silverman D, Wykoff CC, Willis JR. YOSEMITE and RHINE: Phase 3 Randomized Clinical Trials of Faricimab for Diabetic Macular Edema: Study Design and Rationale. Ophthalmol Sci. 2021 Dec 30;2(1):100111. doi: 10.1016/j.xops.2021.100111. PMID: 36246184; PMCID: PMC9559760.
- Иошин И.Э., Аноприева Т.А. Подходы к назначению антиангиогенных препаратов при терапии пациентов с неоваскулярной возрастной макулярной дегенерацией. Российский офтальмологический журнал. 2019;12(3):102-112.

